Anatomie
De PH-regulatie in het menselijk organisme
Het zuur-base evenwicht
Materie: atomen en moleculen
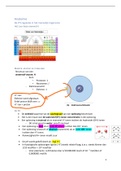
Structuur van een
waterstof-atoom: H
– Kern
• Protonen: 1
• Neutronen: /
– Elektronenschil:
• Elektron: 1
H+ -ion:
Elektron werd afgestaan
Enkel proton blijft over
H+ -ion = proton
De PH
• De eenheid waarmee we de zuurtegraad van een oplossing beschrijven
• Het is een maat voor de waterstof (H+)-ionen concentratie in die oplossing
• Een oplossing is neutraal als er evenveel H+-ionen inzitten als hydroxide (OH-)-ionen
– Dit is het geval in water: proeft neutraal
• Een oplossing is zuur als er méér H+-ionen in zitten dan OH—ionen.
• Een oplossing is basisch of alkalisch (synoniem) als er méér OH—ionen
inzitten dan H+-ionen.
• Aanwezigheid H+ ionen maakt zuur
• De pH wordt gedefinieerd als -log[ H+]
• In fysiologische oplossingen ligt de [ H+] steeds relatief laag, d.w.z. steeds kleiner dan
1/10 mol/liter = 10-1 mol/liter
– Voor plasma bv. is dit kleiner dan 1/10.000.000 mol/L of 10 –7 mol/liter of
0,0000001 mol/lit
1
, • Vandaar dat men zocht naar een werkbaar getal: het negatieve logaritme van de [H+]:
• Men neemt de exponent van de 10de macht en maakt die pos.
• Zo bekom je voor water bv. het cijfer 7; voor plasma: 7,4
• Het is belangrijk te zien dat hoe kleiner de [H+] is, hoe minder zuur dus, hoe groter de
negatieve exponent van de 10de macht (want grotere noemer in breuk), dus hoe
groter (hoger) de pH.
• Een hoger cijfer van pH betekent dus minder zuur, een lager cijfer betekent een
zuurdere oplossing.
– pH 1: is 1/10 mol H+-ionen /L (is 10-1 mol/liter) is 100 maal zuurder dan pH 3
die overeenkomt met 1/1000 mol H+-ionen /L (is 10-3 mol/liter)
Normale waarden van PH
• pH van plasma moet liggen tussen 7,35 en 7,45
• Bij pH van het plasma < 7,35 spreekt men van verzuring of acidose
• Bij pH van het plasma > 7,45 spreekt men van alkalose
• Plasma is minder zuur dan water (ph 7)
Anarganische verbindingen
• pH en concentratie waterstofionen
PH- regulatie
Het is belangrijk dat de pH van het plasma
(en daarmee ook die van het weefselvocht en het
intra-cellulair milieu) zo constant mogelijk blijft.
Om dit te bekomen bestaan er:
1. Buffersystemen
Deze vangen kleine stoornissen in het evenwicht op.
2. Compensatiemechanismen
De uitscheidingsorganen (longen en nieren) zullen
trachten te compenseren indien de capaciteit van de
buffers overschreden wordt.
• Respiratoire compensatie (bij metabole problemen)
• Renale compensatie (bij respiratoire problemen)
2
,Buffersystemen
• Fysiologische buffers zijn mengsels van een zwak zuur en een zout van dat zwak
zuur.
• Ze hebben als doel de pH van een oplossing zo constant mogelijk te houden.
• Wanneer men aan een oplossing waarin een buffersysteem aanwezig is, kleine
hoeveelheden zuur of base toevoegt, zal de pH, nauwelijks wijzigen.
• De zuren (H+-ionen) of de basen (OH—ionen) die toegevoegd worden zullen
‘gebufferd’ worden.
– Ze worden scheikundig ‘gebonden’, zodat ze niet langer ‘vrij’ in de oplossing
voorkomen, en zodoende de pH niet meer beïnvloeden.
Buffersystemen in het bloed
Er zijn een aantal buffersystemen waarvan we er
2 bespreken:
• Het (diwaterstof)carbonaat/bicarbonaat systeem,
– de belangrijkste buffer van het bloedplasma, een extra-cellulair
buffersysteem
• De hemoglobine-buffer,
– de belangrijkste intracellulaire buffer, nl. werkzaam binnenin de rode
bloedcellen
– meer moeite om acidose te vermijden dan alkalose te vermijden → co2 uit
stofwisseling dat altijd gevormd wordt, eiwitten dat we afbreken → door
stofwisseling worden continue organische stoffen en co2 gemaakt waardoor
we verzuren
het carbonaat/bicarbonaat systeem
• De hoeveelheid NaHCO3 (natriumbicarbonaat) in het plasma, noemt men ook de
alkali-reserve.
• Deze beschermt ons tegen het verzurend effect van sterke zuren (stofwisseling)
• Natriumbicarbonaat vormt het sterke zuur om tot een zout van dat sterke zuur, met
vorming van koolzuur (H2CO3)
• Dit koolzuur is een zwak zuur, dat bovendien onder de vorm van CO2 kan uitgeademd
worden (respiratoire compensatie)
Buffering van sterk zuur (HA) door natriumbicarbonaat.
• NaHCO3 + HA NaA + H2CO3
– NaA is een zout van het sterke zuur HA
– (A staat voor ‘acid’)
– Daardoor verschuift het evenwicht:
H2CO3 H2O + CO2 naar rechts
– Het extra gevormde CO2 wordt uitgeademd.
– (longen worden gestimuleerd tot hyperventillatie)
• De hoeveelheid NaHCO3 die in staat is deze zuren te neutraliseren en ons dus tegen
acidose beschermt, noemt men alkali-reserve
3
, De hemoglobine-buffer
• Hemoglobine reageert zuur, bij binding met zuurstof, het splitst dan H +-ionen af
– Er wordt een zout van het zuur gevormd, nl. kaliumhemoglobinaat, KHb
• Hemoglobine kan H+-ionen binden, wanneer het terug zuurstof afgeeft, en in ruil CO2
bindt
– Kalium wordt terug afgesplitst. We schrijven deze gereduceerde vorm als HHb
• We spreken nu van een buffersysteem
– Het mengsel van KHb en HHb, is een buffer
Hemoglobine-buffer
• = vermogen van Hb, om H+ te binden in de weefsels, omdat juist daar door reactie
van CO2 met H2O, veel H+ ontstaat (door koolzuur vorming!)
• Op deze manier, gaat het bloed thv de weefsels, niet extreem verzuren
• (Een bijkomende buffer-rol: kaliumfosfaat-buffer in de RBC)
CO2 vervoer in het bloed:
3 mogelijkheden!
Ter hoogte van de weefsels, komt CO2 de bloedbaan in:
• Een klein deeltje gaat in oplossing (als gas)
• Minder dan de helft: binding aan Hb:
carbamino-binding: HHbCO2 (buffering van Hb)
• Meer dan de helft reageert met H2O tot
koolzuur, dat gedeeltelijk ontbindt in H+ en
HCO3- (bicarbonaat):
dit H+ moet gebufferd worden
4